Nu de helden van de Periodic Table of Videos het periodieke systeem compleet hebben, zijn ze begonnen met het maken van video’s over moleculen. Ging hun eerste video nog over koningswater, nu praten ze in een tweedelige video over een minder exotisch, maar wel problematisch molecuul: CO2. In deel één laten ze koolstofdioxide niet alleen in haar normale verschijningsvormen als gas en vaste stof (droogijs) zien, maar laten ze ook zien dat bij hoge druk koolstofdioxide vloeibaar kan worden.
Dat we in normale omstandigheden alleen vast en gasvormig CO2 tegenkomen, kunnen we zien als we naar het fasediagram ervan kijken. In een fasediagram kun je vinden in wat voor fase (vast, vloeibaar, gas) je een stof tegenkomt bij een bepaalde druk en temperatuur. In onderstaand fasediagram zie je dat CO2 bij standaard temperatuur en druk (aangegeven met “STP” van “Standard Temperature and Pressure”, 25 ºC en 1 atm) een gas is. Ga je naar lagere temperaturen —in het fasediagram ga je dan naar links— dan zie je dat je direct van een gas naar een vaste stof gaat.
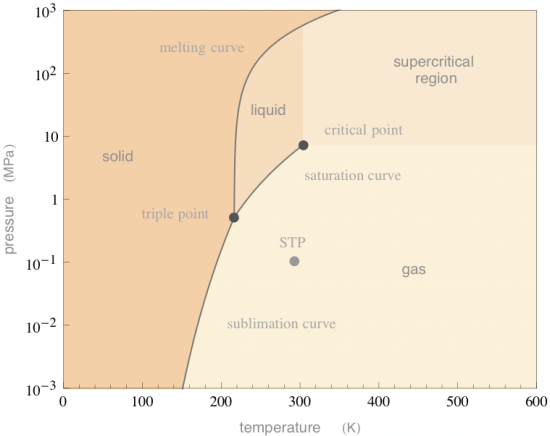 Wil je CO2 in haar vloeibare fase krijgen, dan zul je de druk flink moeten verhogen; minimaal tot de druk die hoort bij het tripelpunt. Het tripelpunt is als een drielandenpunt. Op exact de druk en temperatuur van het tripelpunt is een stof tegelijk in de vaste, vloeibare en gasfase. Bij bijvoorbeeld water is de druk van het tripelpunt lager dan de atmosferische druk. Daarom zien we vast water —ijs— eerst smelten en daarna pas koken. Dat kooldioxide hierin afwijkend is, ligt dus alleen maar aan de ligging van het tripelpunt.
Wil je CO2 in haar vloeibare fase krijgen, dan zul je de druk flink moeten verhogen; minimaal tot de druk die hoort bij het tripelpunt. Het tripelpunt is als een drielandenpunt. Op exact de druk en temperatuur van het tripelpunt is een stof tegelijk in de vaste, vloeibare en gasfase. Bij bijvoorbeeld water is de druk van het tripelpunt lager dan de atmosferische druk. Daarom zien we vast water —ijs— eerst smelten en daarna pas koken. Dat kooldioxide hierin afwijkend is, ligt dus alleen maar aan de ligging van het tripelpunt.
Terug naar de video. Al eerder schreven we dat je een metaalbrand echt niet moet blussen met een CO2 blusser, tenzij je een pyromaan bent natuurlijk. Dit laten ze mooi zien in deel twee van hun video:
Wie weet waar ik zo’n droogijskanon kan kopen?
