Je kent vast wel de uitdrukking “Een druppel op een gloeiende plaat”: een remedie die totaal niet helpt tegen het probleem. Die uitdrukking komt voort uit de gedachte dat een waterdruppeltje op een gloeiende plaat vrijwel direct weer verdampt en daarbij de plaat ook niet merkbaar afkoelt. Dat laatste is inderdaad waar, maar dat eerste niet altijd, zo ontdekte Johann Gottlob Leidenfrost al in 1756.

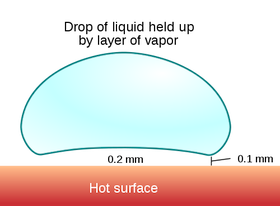
Als de plaat namelijk maar warm genoeg is, verdampt de druppel namelijk een stuk minder snel dan je zou verwachten. Druppels water op een metalen plaat van ruim 200 °C kunnen meer dan een minuut vloeibaar blijven, terwijl ze bij 100 °C binnen hooguit een paar seconde zijn verdampt. Als de plaat maar heet genoeg is, ontstaat er namelijk een kussentje van stoom ónder de waterdruppel. De waterdruppel zweeft boven het oppervlak. Omdat het gaslaagje relatief slecht warmte geleidt, verdampt de waterdruppel nu een stuk langzamer dan wanneer dit gaslaagje er niet was. Dit verschijnsel heet het Leidenfrosteffect.
Het Leidenfrosteffect treedt niet alleen op bij waterdruppels op een hete plaat, maar kan optreden bij elke vloeistof, zolang het oppervlak maar veel warmer is dan het kookpunt van de vloeistof. Het effect treedt bijvoorbeeld ook op wanneer je vloeibare stikstof op een tafel of over de vloer giet. Het oppervlak is dan op kamertemperatuur, maar stikstof kookt al bij -196 °C. Het oppervlak is bezien vanuit de vloeibare stikstof dus in feite gloeiend heet. Dat is ook de reden dat je, zonder bevriezingsverschijnselen te krijgen, een beetje vloeibare stikstof over je hand kunt gieten. Je kunt zelfs je hand kort in een bak met vloeibare stikstof stoppen. Het Leidenfrosteffect beschermt nu je handen tegen de extreme kou van het vloeibare stikstof, doordat er een dun laagje van stikstofgas om je handen ontstaat.
In het onderstaande filmpje van NurdRage wordt het verschijnsel mooi, maar met een enigszins vreemde stem, uitgelegd.
Je kunt het Leidenfrosteffect ook thuis zichtbaar maken door een pan op het fornuis heet te maken en er water op te druppelen. Let op: neem hiervoor een pan zonder anti-aanbaklaag, omdat de Teflonlaag bij hoge temperaturen (260 °C) gaat ontleden. Dat is om te beginnen slecht voor de pan, maar er komen ook ontledingsproducten bij vrij die schadelijk / dodelijk kunnen zijn voor parkieten en andere vogels.
Tot slot kun je het Leidenfrosteffect ook gebruiken om je hand in vloeibaar lood van 350 °C te kunnen stoppen zonder je hand te verbranden, door je hand eerst nat te maken. Het water zal dan snel verdampen en een gaslaagje vormen om je hand, zoals de MythBusters laten zien.