Het zoeken naar de kortste weg door een doolhof is iets dat we allemaal vrijwel dagelijks doen, waarschijnlijk zelfs zonder er bij na te denken. Bijvoorbeeld als je naar je school of werk fietst. Of als je door de supermarkt loopt op zoek naar al je boodschappen. Ook computers worden regelmatig ingezet voor de wat moeilijkere doolhof-problemen, bijvoorbeeld als je een route via de bus of trein plant via 9292ov.nl.
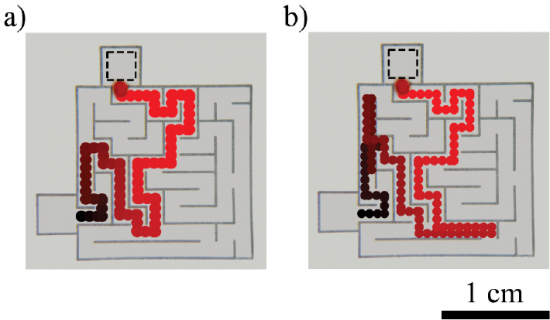
Maar wat heeft dat in vredesnaam met scheikunde te maken? In eerste instantie niets, zou je zeggen. Maar niets is minder waar, want op Ars Technica las ik dat wetenschappers van de Northwestern University (Illinois, USA) er in zijn geslaagd om een oliedruppeltje zelfstandig de kortste route door een doolhof te laten vinden door slim gebruik te maken van zuren en basen in een doolhofje zoals in onderstaand figuur. Het doolhofje werd gevuld met een waterige kaliumhydroxide (KOH) oplossing met een pH tussen de 12,0 en 12,3.
Bij de ‘uitgang’ van het doolhof zetten ze een stukje agarose-gel dat een tijdje in zoutzuur (pH van 1,2) had gelegen. Hierdoor ontstond er na korte tijd een gradiënt in de pH in het doolhof: de pH was laag vlakbij het blokje en liep op naarmate je er verder uit de buurt was. Bij de ‘ingang’ (hoge pH) van het doolhof werd een oliedruppeltje neergezet dat op het water bleef drijven. Dit oliedruppeltje bestond verder nog voor 20–60% uit een organisch zuur, namelijk 2-hexyldecaanzuur (afgekort HDA), en een beetje rode kleurstof voor de zichtbaarheid.
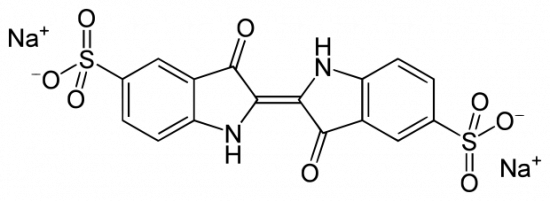
HDA is oppervlakte-actief. Dat wil zeggen dat het graag aan een oppervlak tussen twee fasen gaat zitten (een grensvlak), bijvoorbeeld aan het olie-lucht of olie-water grensvlak. Hiermee verlaagt het de oppervlaktespanning en daarmee de energie die het kost om zo’n grensvlak te maken. De slimmigheid is nu dat HDA vooral oppervlakte-actief is als de zuurgroep van dit molecuul nog geprotoneerd is. Oftewel, HDA is vooral oppervlakte-actief in een zure omgeving en niet in de basische omgeving waar het druppeltje start.
Hierdoor heeft het druppeltje in een basische veel oppervlakte energie en in een zure omgeving minder. Het druppeltje kan zijn energie dus verlagen door naar de zure kant te bewegen en dit zal hij ook zeker doen. Omdat de pH gradiënt het grootste is langs de kortste route door het doolhof, neemt het druppeltje ook nog eens automatisch de kortste route door het doolhof met het zure blokje met agarose-gel als het lokaas. En dat zonder ook maar iets te rekenen. Dus de volgende keer als je in een doolhof zit opgesloten en de Minotaurus zit achter je aan, zorg dat je genoeg water en gootsteenontstopper bij je hebt om een doolhof mee te vullen.
De wetenschappers hebben hun resultaten gepubliceerd in het Journal of the American Chemical Society (JACS). Op de website van het JACS zijn ook een aantal gave filmpjes te vinden van de bewegende oliedruppels. Zeker het bekijken waard.