De Scheikundejongens zijn enorm fan van experimenten die je zelf thuis kunt doen. Maar sommige experimenten kun je maar beter niet doen. In de categorie Don’t Do It Yourself (DDIY): het mengen van schoonmaakmiddelen. Op verpakkingen van schoonmaakmiddelen lees je vaak dat je dit niet mag doen. Maar waarom eigenlijk? Om dat te kunnen beantwoorden, moeten we eerst kijken waar schoonmaakmiddelen uit bestaan.

De precieze samenstelling van schoonmaakmiddelen verschilt van product tot product, maar er zijn natuurlijk ook grote overeenkomsten. Vrijwel alle schoonmaakmiddelen — van afwasmiddel tot waspoeder — bevatten oppervlakte-actieve stoffen (surfactanten), met als uitzondering bijvoorbeeld spiritus of aceton. Oppervlakte-actieve stoffen zijn moleculen met een hydrofiele kop en een hydrofobe staart: hun hoofd wil graag in water zitten, hun staart in vet en olie. Daardoor worden vet en olie een stuk gemakkelijker om te verwijderen. Een blokje zeep bestaat praktisch alleen maar uit dit soort moleculen.
Sommige schoonmaakmiddelen bevatten ook bleekmiddelen. Een bleekmiddel is niets meer dan een oxidator. Er zijn twee belangrijke soorten: chloorbleekmiddelen en zuurstofbleekmiddelen. Een voorbeeld van de eerste soort is hypochloriet (ClO–), van de tweede waterstofperoxide (H2O2). Deze stoffen zijn goed in het afbreken van organische verbindingen (zoals kleurstoffen) en hebben daarom een blekende werking. De ‘gewone’ Glorix bevat hypochloriet. Glorix O2 bevat waterstofperoxide (dat is dus wat ze bedoelen met de kreet actieve zuurstof formule op de verpakking).
Andere schoonmaakmiddelen bevatten bijvoorbeeld weer (verdund) zoutzuur. Zoutzuur is niet echt een sterke oxidator, maar wel een sterk zuur, wat ook helpt om allerlei vuil weg te krijgen. Een voorbeeld hiervan is Harpic Max.
Maar wat gebeurt er dan als je verschillende (soorten) schoonmaakmiddelen mengt? Dat hangt natuurlijk af van de combinatie. Meng je een zoutzuur-houdend middel met een waterstofperoxide-houdend middel, dan gebeurt er ogenschijnlijk niks. Echter, het resulterende mengsel is iets dat sommige hobbyisten nog wel eens gebruiken om printplaten mee te etsen. Het toevoegen van zuur maakt waterstofperoxide namelijk een sterkere oxidator. Agressief spul dus, en niet iets voor thuis.
Het mengen van hypochloriet met waterstofperoxide geeft wel direct een zichtbare reactie. Het hypochloriet reageert met het waterstofperoxide onder vorming van onder andere zuurstofgas. Niet direct heel gevaarlijk, tenzij er brandbare materialen in de buurt zijn. De reactie is hieronder weergegeven:
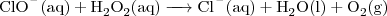 .
.
De derde en laatst combinatie is meteen ook de gevaarlijkste: hypochloriet en zoutzuur. Meng je die twee, dan ontstaat er chloorgas, wat zelfs in lage concentraties extreem giftig of zelfs dodelijk is. Ook kan het bijvoorbeeld brandwonden veroorzaken. Het chloorgas wordt als volgt gevormd:
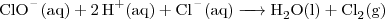 .
.
Conclusie: meng dus nooit schoonmaakmiddelen met elkaar. Dat staat natuurlijk ook al op de verpakking, maar sommige mensen doen het toch (filmpje). Als je dan toch twee verschillende schoonmaakmiddelen wilt gebruiken om een hardnekkige vlek weg te krijgen, spoel dan tussendoor met voldoende water.
Met dank aan Lucas Keijning voor het idee.
 En wij zouden de Scheikundejongens niet zijn, als we het slechtste idee niet uit het boek zouden inscannen en publiceren. Maar niet voordat we jullie het stichtelijke gedeelte uit het voorwoord hebben laten lezen:
En wij zouden de Scheikundejongens niet zijn, als we het slechtste idee niet uit het boek zouden inscannen en publiceren. Maar niet voordat we jullie het stichtelijke gedeelte uit het voorwoord hebben laten lezen: Lees hieronder hoe je HCl (g) kan maken. Mijn nederige excuses voor het verkeerd instellen van de scanner.
Lees hieronder hoe je HCl (g) kan maken. Mijn nederige excuses voor het verkeerd instellen van de scanner.