De Scheikundejongens gaan met hun tijd mee. Een tijdje terug was daar ineens een twitteraccount en sinds vorige week kun je hartjes uitdelen aan de Scheikundejongens; zelfs als het geen valentijnsdag is. En vandaag introduceren we weer iets nieuws!
Als je een Android telefoon, BlackBerry, iPhone of iPod touch hebt, dan kun je de Scheikundejongens nu overal lezen. Bezoek je vanaf nu deze site met één van de genoemde apparaten, dan krijg je vanzelf een compacte versie te zien die geoptimaliseerd is voor mobiel gebruik en bediening met je vingers. Je kunt de site ook nog toevoegen aan je beginscherm, zodat je altijd een beetje van 2Sj op je iPhone hebt.
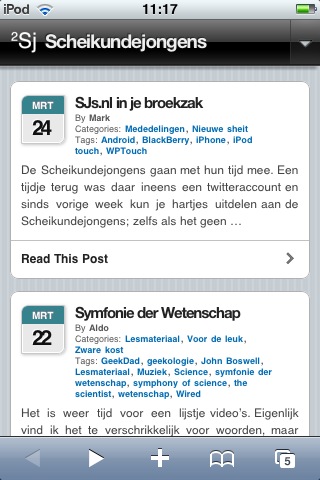

De meeste features die onze normale site heeft, vind je ook terug op de mobiele site. Je kunt berichten lezen en reacties lezen én plaatsen. Ook kun je berichten zoeken op tag en categorie. Daarnaast kun je inloggen met je account (als je die hebt). Dit doe je via het ‘driehoekje’ rechtsboven. Vooralsnog zijn er twee dingen die niet werken: het “ik vind dit leuk” knopje is afwezig en ingevoegde YouTube filmpjes doen het ook niet. Het laatste is gelukkig een bug in onze YouTube-plugin, dus dat lossen we hopelijk snel op. Met koningswater, natuurlijk. Als jullie nog andere gekke dingen tegen komen, horen we dat natuurlijk graag.
Zodra één van de Scheikundejongens rijk genoeg is om een iPad te kunnen betalen, zullen we daar natuurlijk ook compatibele versie voor gaan maken. Laat die donaties maar komen!