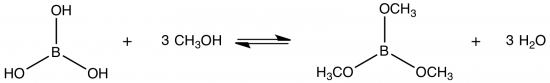
Een tijdje geleden had ik het genoegen om een lezing van prof. David MacKay bij te wonen. Al eerder schreven we over zijn fantastische boek. De gelegenheid waar hij sprak had te maken met een donatie van 20 miljoen Britse ponden aan het instituut waar ik nu stage loop. Gelukkig bleef hij nuchter en hield hij een eerlijk praatje.
Wat ik zo speciaal aan prof. MacKay vind, is zijn manier van uitleggen. Klimaatverandering en energiebesparing zijn geen gemakkelijke onderwerpen. Alleen al de wetenschappelijke concepten zijn niet eenvoudig, dus als daar dan ook nog eens morele en culturele overwegingen bij komen, is het goed te begrijpen dat de discussies snel uit de hand kunnen lopen. Ik denk dat het onze plicht als wetenschappers is, om niet-deskundigen uit te leggen zijn wat de feiten zijn. Een extreem handig middel is het concept van prof. MacKay: de gloeilamp. In een eerder filmpje van hem hier, konden we horen hoe hij uitlegde dat een 40 watt lamp elke dag 1 kilowattuur (kWh) gebruikt. Omdat joules en watturen lastige eenheden zijn om mee te rekenen — die eenheden zeggen niet veel mensen wat — introduceert hij de lamp. 24 uur een lamp aan laten is een duidelijk concept. Al het energiegebruik omrekenen naar eenheden van “gloeilampen” is een handig gedachtenexperiment.
Als wij, de Scheikundejongens, diep in ons hart kijken, zullen we ontdekken dat we alleen maar willen uitleggen. Dit soort vereenvoudigende concepten zijn hierin verschrikkelijk belangrijk.
Prof. MacKay is adviseur voor de Britse overheid. Hij adviseert de overheid over energie en klimaatverandering. Om de gevolgen van beslissingen over energie duidelijk te maken in het jaar 2050, heeft hij een een webtool gemaakt. Het is een programmaatje op het Internet waarmee iedereen kan “uitrekenen” wat elke energiebesparing voor nut heeft. Het is niet echt uitrekenen, maar meer het aanvinken van beslissingen. Een korte introductie door prof. MacKay zelf:
Ik vind dit een heel erg interessante gedachte: zelf kunnen zien wat elke overweging voor gevolgen heeft voor het jaar 2050. Geen geklier met moeilijke formules, niks vergeten en geen “ja maar…”. Als we meer en meer energie willen gebruiken, zullen er ook meer manieren moeten komen om energie op te wekken. Maar als we bepaalde manieren niet willen, dan zullen we ook minder energie moeten gaan gebruiken. Simpel als dat. Ik heb zelf even met de tool gespeeld en ik denk dat dit wel een interessante optie is:
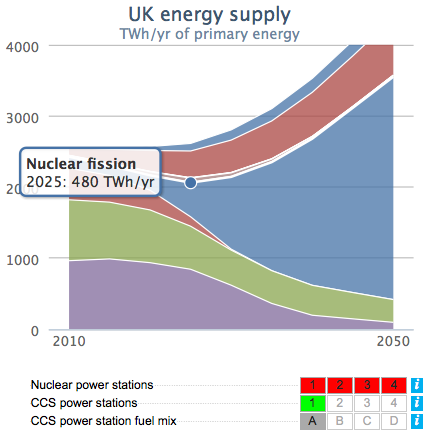
De daadwerkelijke webtool vind je hier en meer informatie over de tool hier. Er is onder het tabblad “Story” ook interessante achtergrondinformatie te vinden. Bekijk ook zeker eens de “Example Pathways”. Laat me alsjeblieft weten wat jullie van dit soort websites vinden, in de commentaren hieronder. Zou er ook een Nederlandse variant moeten komen? Is dit interessant voor het Nederlands scheikundeonderwijs?