Wanneer iets brandt, zie je meestal een blauwe of gele vlam, afhankelijk van of de verbranding volledig is, of niet. Dat kun je mooi zien met een Bunsenbrander: draai je de luchttoevoer open, dan verandert de kleur van de vlam van geel naar blauw. Maar heb je wel eens groen vuur gezien? Bekijk het onderstaande filmpje.
In het filmpje wordt boorzuur (H3BO3) gemengd met een soort anti-vries en daarna aangestoken. De anti-vries bestaat voor het overgrote deel uit methanol (CH3OH), wat brandt met een blauwe vlam. Boorzuur is niet brandbaar. Hoe wordt de groene kleur dan veroorzaakt?
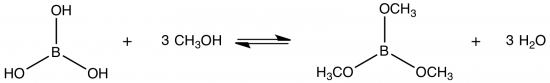
Wanneer booratomen in een vlam terechtkomen, gaan ze licht uitzenden, net als andere metaalatomen. Dit wordt vlamkleuring genoemd. Hiervan wordt niet alleen in vuurwerk gebruik gemaakt, maar bijvoorbeeld ook in de chemische analyse (AAS en AES). Boorzuur op zichzelf is helaas niet vluchtig genoeg om in de methanol-vlam terecht te komen: het heeft een kookpunt van 300 °C. Boorzuur reageert echter wel met methanol tot trimethylboraat, zoals je kunt zien in bovenstaande reactievergelijking. Dit trimethylboraat heeft een kookpunt van ongeveer 68 °C en verdampt dus wél door de warmte van de vlam. Eenmaal in de vlam valt het molecuul uit elkaar, waarna de booratomen hun karakteristieke groene kleur licht uitzenden. Het boor reageert uiteindelijk tot booroxide.

De reactie tussen methanol en boorzuur is een soort veresteringsreactie, zoals die ook kan optreden tussen alcoholen en organische zuren. Wanneer je hetzelfde probeert met boorzuur en ethanol, treedt de reactie (vrijwel) niet op. De vlam is dan niet groen, maar gewoon blauw.
Je kunt dit experiment ook thuis of op school uitvoeren. Boorzuur, methanol en ethanol zijn verkrijgbaar bij de betere apotheek of drogist. In plaats van ethanol kun je ook spiritus gebruiken, wat voor het grootste deel uit ethanol bestaat. Let op: methanol en boorzuur zijn giftig. Werk in een goed geventileerde ruimte, bij voorkeur in de zuurkast, en houd brandbare materialen uit de buurt. Ontsteek het mengsel in een vuurvast schaaltje, bijvoorbeeld het metalen omhulsel van een waxinelichtje. We zien uit naar de foto’s van jullie groene vlammen.
Met dank aan de Scholieren Quiz Chemie “SQuiz” voor het idee voor dit experiment.