Een boel dingen die voor ons in het dagelijks leven vanzelfsprekend zijn, worden compleet anders wanneer de zwaartekracht weg zou zijn. We hebben allemaal wel eens gewichtloze astronauten in de ruimte zien spelen met waterdruppels: die worden perfect rond als gevolg van de oppervlaktespanning. Drinken bijvoorbeeld wordt dus al lastig, want water blijft niet meer in een bekertje zitten.

Maar ook chemische processen worden beïnvloed door zwaartekracht. Neem nou het branden van een kaars. Wanneer je dit op aarde doet, zie je een gele, langwerpige vlam. Door de hoge temperatuur is de dichtheid van de vlam lager dan de lucht eromheen. Je krijgt dus convectie: de gassen in de vlam, zoals nog onverbrand kaarsvet, koolstofdioxide, water en allerlei tussenproducten, stijgen op en daardoor wordt lucht aangezogen aan de onderkant. Dit geeft de vlam zijn langwerpige vorm. Ook krijg je hierdoor onvolledige verbranding: hoger in de vlam is de temperatuur lager. Er ontstaan dan roetdeeltjes die (als een zwarte straler) oplichten in de vlam. Dit geeft de vlam zijn gelige kleur.
Zónder zwaartekracht maakt het niet meer uit dat de dichtheid van warme lucht lager is. Warme lucht stijgt niet meer op, dus wordt er geen verse lucht aangezogen. De vraag is dus: kan een kaars dan nog wel branden in de ruimte? En waarom wel of niet?
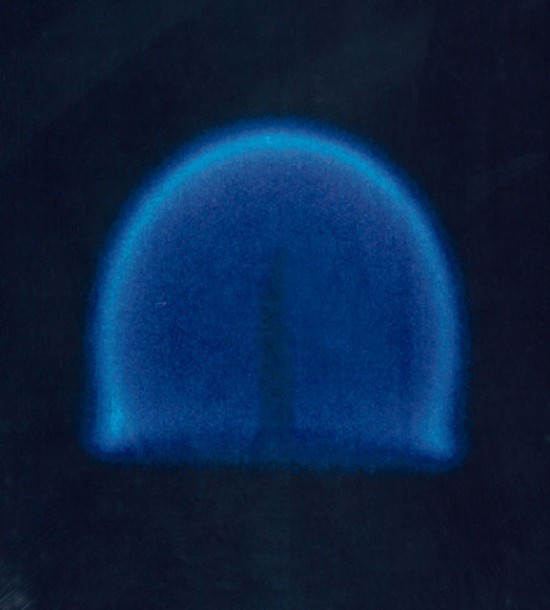
Ook de ruimtevaartorganisatie NASA stelde zichzelf deze vraag. Het antwoord zie je op het plaatje hiernaast. Kaarsen branden dus prima in de ruimte, maar doen dat wel heel anders dan op aarde. De vlam is niet meer langgerekt en geel, maar bolvormig en blauw. Er is geen convectie, dus de vlam blijft bolvormig en moet door middel van diffusie aan zuurstof komen. Dit is een traag proces, maar het betekent tegelijk dat er volledige verbranding plaats kan vinden. Allerlei tussenproducten worden niet meer te snel weggevoerd, dus er ontstaat geen roet en de vlam is dus niet meer geel.
Als je goed kijkt — en in onderstaand plaatje is dat nog iets beter te zien — zie je ook dat de verbranding alleen plaatsvindt aan het ‘oppervlak’ van de bol. Dat kan ook niet anders: binnen de bol is er geen zuurstof, buiten de bol geen brandstof.
 Tot slot vond ik ook nog een artikel van de NASA over het verbranden van waterstof in bij gewichtloosheid. Het waterstof vormt dan brandende bolletjes. Bolbliksem kende ik wel, maar bolvlammen waren nieuw voor me. Gaaf!
Tot slot vond ik ook nog een artikel van de NASA over het verbranden van waterstof in bij gewichtloosheid. Het waterstof vormt dan brandende bolletjes. Bolbliksem kende ik wel, maar bolvlammen waren nieuw voor me. Gaaf!

 Op de middelbare school heerste de doctrine dat de dingen die je op Internet leest, niet te vertrouwen zijn. Als ik nu naar een getal zoek, check ik
Op de middelbare school heerste de doctrine dat de dingen die je op Internet leest, niet te vertrouwen zijn. Als ik nu naar een getal zoek, check ik 