Katoen komen we in het dagelijks leven erg veel tegen, bijvoorbeeld in bankbiljetten en kleding (spijkerbroeken, T-shirts en labjassen). Het heeft namelijk erg prettige eigenschappen: het gaat lang mee, brandt slecht en kan goed tegen allerlei chemicaliën.
Katoen bestaat voor een groot deel (>90%) uit cellulose. Dit is een polymeer dat bestaat uit aan elkaar gekoppelde glucosemoleculen. Dit soort polymeren worden ook wel polysacharides genoemd. In onderstaande afbeelding zie je hoe twee van die glucosemoleculen aan elkaar zijn gekoppeld. In één cellulose-molecuul kunnen meer dan tienduizend glucose-eenheden aan elkaar geknoopt zitten.
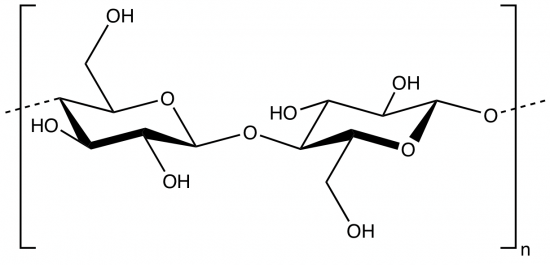
Cellulose bevat OH-groepen en daar kunnen organisch chemici veel leuke dingen mee. Zulke functionele groepen kunnen namelijk gemakkelijk allerlei reacties aangaan, zoals veresteringen. Een voorbeeld van zo’n verestering is het aanbrengen van nitraatgroepen (R-O-NO2). Wat dan ontstaat, ziet er als volgt uit:
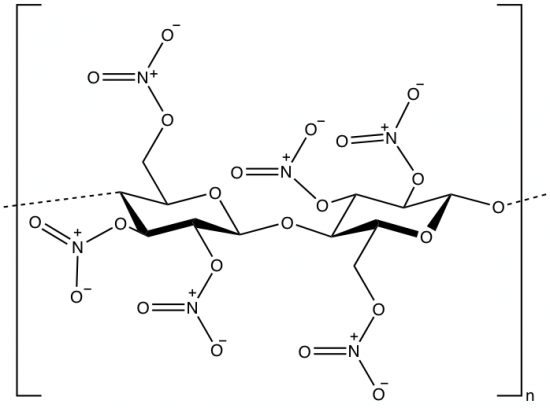
Bovenstaande stof heet schietkatoen. Ook de term nitrocellulose kom je vaak tegen, maar deze is eigenlijk fout: in het molecuul zitten geen nitrogroepen, alleen nitraatgroepen. Een betere naam is dan ook cellulosenitraat.
In tegenstelling tot gewoon katoen brandt schietkatoen super snel. Dat komt omdat de nitraatgroepen als inwendige zuurstofleverancier functioneren: er hoeft daardoor minder zuurstof uit de lucht te worden gehaald. Dat kun je heel mooi zien in onderstaand filmpje. Hierin zie je eerst gewoon katoen branden en daarna schietkatoen.
Zelf schietkatoen maken is vrij eenvoudig, maar niet zonder gevaar. Doe dit dus onder professionele begeleiding, bijvoorbeeld met je docent scheikunde.
Voor het maken schietkatoen heb je het volgende nodig:
- 100 mL bekerglas;
- 1 L bekerglas;
- pincet;
- glazen roerstaaf;
- watten (van 100% katoen, staat op de verpakking);
- geconcentreerd salpeterzuur;
- geconcentreerd zwavelzuur;
- wat papieren doekjes zoals keukenpapier (optioneel).
Schietkatoen maak je als volgt. Voer onderstaande altijd uit in een zuurkast. Er komen nogal nare dampen bij vrij.
- Begin met het maken van nitreerzuur. Breng hiertoe 25 mL salpeterzuur in het 100 mL bekerglas. Schenk vervolgens, terwijl je roert, langzaam 50 mL zwavelzuur bij het salpeterzuur. De oplossing wordt heet. Let op: schenk altijd zwavelzuur bij salpeterzuur en doe nooit het omgekeerde! Als je knoeit met nitreerzuur, ruim dit dan niet op met papier, want dan nitreer je het papier. Spoel het weg met veel water.
- Laat de oplossing afkoelen tot ongeveer kamertemperatuur.
- Wanneer de oplossing is afgekoeld, leg je er een paar katoenen watjes in. Gebruik hiervoor het pincet.
- Vul het 1 L bekerglas met water. Breng de watten, nadat ze een kwartier in het nitreerzuur hebben gelegen, over in het bekerglas met water en roer eventjes om het nitreerzuur grotendeels weg te spoelen.
- Haal de watten uit het water leg ze op een doekje. Leeg het bekerglas in het afvalvat ‘anorganisch/zuur’ en vul het weer met water. Maak de watten opnieuw schoon. Herhaal dit een aantal keer totdat het water niet meer zuur is. Dit kun je controleren met een pH papiertje of door het toevoegen van wat natriumwaterstofcarbonaat (zie je gasontwikkeling, dan is het nog zuur).
- Maak de watten zo droog als mogelijk door ze uit te persen tussen twee papieren doekjes.
- Laat de watten enige tijd drogen aan de lucht, totdat ze droog aanvoelen. Het is af te raden om het schietkatoen te drogen in een droogstoof, omdat het dan spontaan kan ontbranden.
Om het gedroogde schietkatoen te testen, leg je een klein plukje op iets dat vuurvast is. Steek het aan met een lange keukenaansteker, gloeiende houtspaander of (mijn favoriet) een hete glazen staaf. Als alles goed is gegaan, zie je iets soortgelijks als op onderstaande foto.

Tot slot een profielwerkstuktip: als je dit een interessant onderwerp vindt, zou je voor je profielwerkstuk kunnen kijken hoe de brandsnelheid wordt beïnvloed door samenstelling van het nitreerzuur (verhouding salpeterzuur/zwavelzuur) en de tijd die het katoen in het nitreerzuur doorbracht.

 ) of gebruik je één van onze tien cijfers (1; 2; 3; 4; 5; 6; 7; 8; 9; 0).
) of gebruik je één van onze tien cijfers (1; 2; 3; 4; 5; 6; 7; 8; 9; 0).