De wereld van de vloeibare kristallen stond kort geleden even op zijn kop. De “Assepoester van de vloeibare kristallen” was eindelijk, veertig jaar nadat deze theoretisch was voorspeld, onomstotelijk experimenteel gevonden. Voordat ik ga uitleggen wat er nu precies is gevonden, zal ik eerst vertellen wat een vloeibaar kristal eigenlijk is.
Veel stoffen komen voor in drie fasen: als vaste stof, vloeistof en gas. Van de vaste stoffen hebben er veel een kristalstructuur, de atomen, moleculen of ionen zijn in alle richtingen netjes gerangschikt. Je kunt ook zeggen dat er in een kristal orde is in alle drie de dimensies.

Ga je een kristal verwarmen zodat het smelt, dan verdwijnt die orde tegelijk in alle drie de dimensies, zo zou je denken. Bij de meeste stoffen in ons dagelijks leven is dit ook zo, maar dat is alleen maar zo omdat de atomen/moleculen/ionen waaruit die stof bestaat, ongeveer bolvormig (of erg flexibel) zijn.
Wanneer de moleculen niet ongeveer bolvormig zijn, gebeurt het soms dat de wanorde niet tegelijk in alle richtingen toeslaat. Je krijgt dan iets dat tussen een kristal en een vloeistof in zit, vandaar de naam vloeibaar kristal. Voor staafvormige deeltjes krijg je bijvoorbeeld een vloeibaar kristal waarin alle staafjes dezelfde kant op wijzen, terwijl ze wel vrij alle kanten op kunnen bewegen, zoals in het plaatje hiernaast. Dit heet met een duur woord een nematische fase.
Vloeibare kristallen kun je niet alleen krijgen met niet-bolvormige moleculen, maar ook met colloïden. Colloïden zijn deeltjes tussen de 1 nm en 1 µm. Ze kunnen van allerlei materialen (zoals plastic en silica) en in allerlei vormen worden gemaakt. Wanneer je staafvormige colloïden in een oplosmiddel stopt, kun je net als bij de staafvormige moleculen een nematische fase krijgen. Dit gebeurt puur doordat de afmetingen van de deeltjes in één richting (de lengte) duidelijk anders zijn dan in de andere twee richtingen.
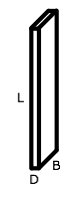 Maar wat gebeurt er als we colloïden maken waarvan de afmetingen in alle drie de dimensies anders zijn? Dit is bijvoorbeeld het geval voor plaatvormige deeltjes met lengte L, breedte B en dikte D die alledrie van elkaar verschillen, zoals in de afbeelding hiernaast. Uit theoretische voorspellingen is gebleken dat wanneer de verhouding van lengte en breedte ongeveer gelijk is aan de verhouding van breedte en dikte
Maar wat gebeurt er als we colloïden maken waarvan de afmetingen in alle drie de dimensies anders zijn? Dit is bijvoorbeeld het geval voor plaatvormige deeltjes met lengte L, breedte B en dikte D die alledrie van elkaar verschillen, zoals in de afbeelding hiernaast. Uit theoretische voorspellingen is gebleken dat wanneer de verhouding van lengte en breedte ongeveer gelijk is aan de verhouding van breedte en dikte 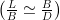 er een zogeheten biaxiale nematische fase zou moeten vormen.
er een zogeheten biaxiale nematische fase zou moeten vormen.
Met een biaxiale nematische fase wordt bedoeld dat deeltjes oplijnen langs twee assen (bi-axiaal). De deeltjes wijzen dus niet alleen dezelfde kant op, ze staan ook nog eens met dezelfde kant naar elkaar toe, zoals in onderstaand plaatje is geschetst.
Het spannende is nu dat dit type vloeibaar kristal al veertig jaar geleden was voorspeld. Tot nu was echter nog nooit onomstotelijk experimenteel bewezen dat het ook écht bestond. Promovenda Esther van den Pol aan de Universiteit Utrecht is er in geslaagd om deze fase aan te tonen. Dit is gedaan met plaatvormige goethiet (α-FeOOH) colloïden met afmetingen van 254 x 83 x 28 nm, oftewel L/B = 3,1 en B/D = 3,0. Zoals je ziet zijn L/B en B/D inderdaad ongeveer gelijk aan elkaar, zoals de theorie voorspelde.
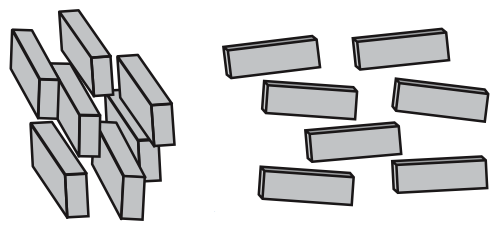




 Foto gevonden op
Foto gevonden op